Lääkeaineiden ”perillesaannin” haasteet ja ratkaisut

Lääkeaineiden ”perillesaannin” haasteet ja ratkaisut
Tehokkaita lääkeaineita löydetään ja kehitetään tänä päivänä kohtalaisen helposti. Tietokone-avusteinen lääkeainesuunnittelu on viime vuosikymmeninä nopeuttanut uusien, jopa kohteensa kanssa valikoivasti vaikuttavien lääkeaineiden löytymistä.
Lääkeainekehityksessä voidaan nykyään hyödyntää myös kryoelektronimikroskopiaa. Se on tutkimusmenetelmä, jossa saadaan kuvattua tarkasti makromolekyylien rakenteita hyvin kylmässä olosuhteessa elektronisuihkun avulla. Sen avulla tutkijat voivat nykyään määrittää, miltä lääkeainekohteet, kuten proteiinit, näyttävät kolmiulotteisina niiden luonnollisessa muodossaan. Kun lääkeainekohteen muoto tunnetaan, voidaan selvittää potentilta lääkeaineelta vaadittava kemiallinen rakenne, jota tarvitaan sopivien vuorovaikutussuhteiden ja siten farmakologisen vasteen saavuttamiseksi.
Tietokone-avusteisesti laskennallisin menetelmin voidaan näin suunnitella uusia lääkeaineita, jotka sitoutuvat lääkeainekohteeseen juuri oikein. Puhutaan niin kutsutusta avain-lukko-teoriasta, jossa lääkeaineet toimivat kuin avaimet, joiden tulisi avata oikea lukko.
Lääkeaineiden kehittämistä helpottaa edelleen se, että modernit työkalut mahdollistavat suurien molekyylikirjastojen seulomisen uusien lääkeainekandidaattien löytymiseksi. Niiden avulla voidaan myös vanhoille lääkeaineille löytää uusia käyttökohteita. Vähitellen olemme siis päässeet yleisavaimesta vain tiettyihin lukkoihin sopivien avainten löytymiseen.
Valitettavasti suurin osa avaimista eli lääkeaineista ei päädy oikean lukon luokse sellaisina pitoisuuksina, jolla voitaisiin saavuttaa farmakologinen vaste. Esimerkiksi aivojen eri sairaudet ovat vuosikymmenien ajan olleet vaikeasti hoidettavissa, koska lääkeaineet eivät läpäise helposti veri-aivoestettä – suojamuuria, joka suojelee aivojamme haitallisilta molekyyleiltä. Toisaalta monet edelleen käytössä olevat syöpälääkkeet päätyvät syöpäsolujen lisäksi myös muualle elimistöön aiheuttaen merkittäviä sivuvaikutuksia, jotka voivat jopa estää lääkityksen jatkumisen.

Miten lääkeaineet saadaan sitten kohdennettua?
Lääkeaineiden kulkeutumista elimistössä ja kohdentamista haluttuun vaikutuspaikkaan voidaan tehostaa hyödyntämällä erilaisia biologisia kuljetusmekanismeja ja kemiallisia valmistustekniikoita. Jo pelkästään lääkevalmisteen antotavalla voidaan vaikuttaa sen sisältämän lääkeaineen päätymiseen lähelle kohdettaan.
Esimerkiksi kun tulehduskipulääkettä annostellaan voiteen muodossa paikallisesti kipukohtaan, alkaa sen kipua lievittävä vaikutus lihaksessa nopeammin kuin, jos sama kipulääke otettaisiin suun kautta. Toisaalta suun kautta otettavalla kipulääkkeellä pystytään samanaikaisesti lievittämään niin päänsärkyä kuin kihtivarpaan kipuakin, mitä olisi mahdotonta saavuttaa paikallisesti yhteen kohtaan annosteltavan kipugeelin avulla.
Koska valtaosa lääkkeistä on suun kautta otettavia, monet lääkeaineet jakautuvat elimistön eri kudoksiin verenkierron välityksellä. Riippuen lääkeaineen tarkoitusperästä tämä voi kumminkin aiheuttaa myös ei-toivottuja sivuvaikutuksia.
Nykyisin ymmärrämme entistä paremmin sitä, millaisia molekyylitason muutoksia eri sairauksiin liittyy ja kuinka geeniperimämme vaikuttaa lääkehoidon onnistumiseen. Sen vuoksi onkin alettu puhua personoidusta lääkehoidosta. Siinä potilaan geeniperimä pyritään selvittämään, sekvenoimaan, jotta kullekin potilaalle löydettäisiin esimerkiksi syövän hoidossa juuri oikealla tavalla vaikuttava lääkeaine. Tämä ei silti vielä takaa, että kyseinen syöpälääke löytää oikeaan vaikutuspaikkaansa eli syöpäkudokseen ja sairauden takia muuntuneisiin soluihin.
Lääkeaineiden imeytymistä, jakautumista ja kulkeutumista soluihin, metaboliaa eli pysyvyyttä ja eläimistöstä poistumista kutsutaan farmakokineettisiksi ominaisuuksiksi. Niitä on pyritty kautta historian muovaamaan kullekin lääkeaineelle sopiviksi. Muuttamalla lääkeaineiden fysikokemiallisia ominaisuuksia lääkeaineiden kulkeutumista kohteeseensa onkin monissa tapauksissa pystytty monin kerroin parantamaan (Rautio ym. 2018).
Farmakokineettisiin ominaisuuksiin voidaan vaikuttaa esimerkiksi lääkeaineen rakenteellisilla muutoksilla, joilla parannetaan niiden vesiliukoisuutta, rasvaliukoisuutta tai stabiilisuutta. Vesiliukoisuus on hyödyksi, koska vain liuennut lääkeaine voi imeytyä, ja rasvaliukoisen aineen on taas ajateltu läpäisevän solukalvosto tehokkaammin. Stabiiliuudella tarkoitetaan sitä, että lääkeaine ei muutu liian nopeasti inaktiiviseksi tai kerry haitallisesti elimistöön.
Ominaisuuksiin on silti hyvin haasteellista vaikuttaa niin, että lääkeaineen vuorovaikutukset kohdeproteiiniinsa kanssa pysyisivät optimaalisina eli tarpeeksi tehokkaina. Lisäksi on sanomattakin selvää, että on vieläkin haastavaa, ellei jopa mahdotonta, löytää sopiva tasapaino vesiliukoisuuden ja rasvaliukoisuuden välillä.
Koska farmakokineettisten ominaisuuksien muokkaamiseen liittyy hankaluuksia, tutkimuksen mielenkiinnonkohteet ovatkin suuntautuneet elimistön erilaisten kuljetusmekanismien ymmärtämiseen ja niitä hyödyntäviin tekniikoihin, kuten aihiolääke-teknologiaan. Niistä on kehittynyt olennaisia osia kokonaisvaltaista lääkekehitystyötä.
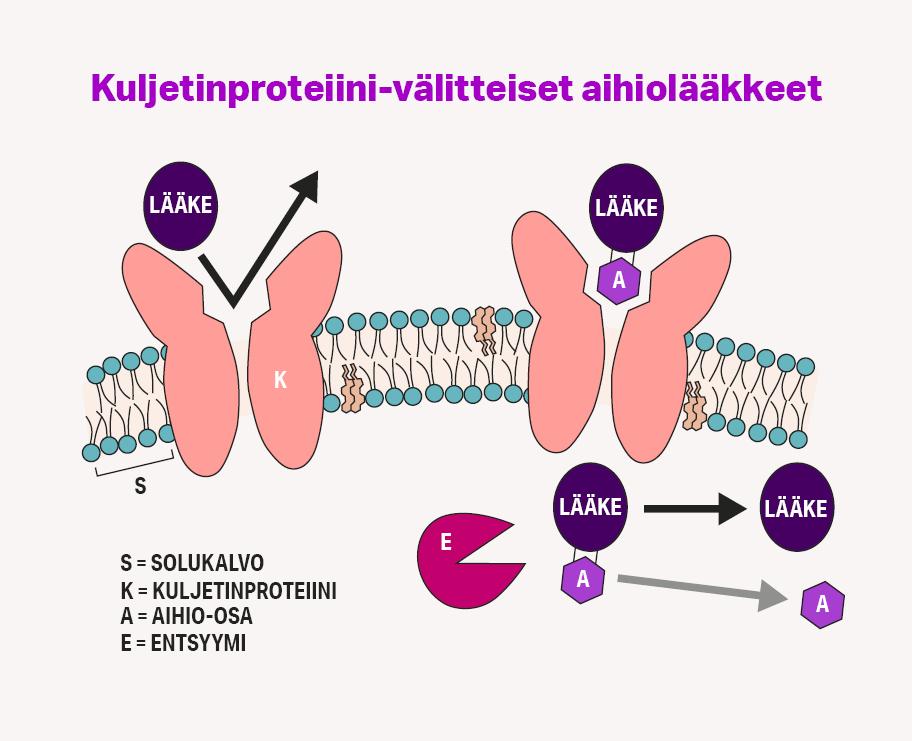
Aihiolääkkeet ovat lääkeaineiden väliaikaisesti muokattuja muotoja, jotka ovat inaktiivisia tai huomattavasti vähemmän aktiivisia kuin alkuperäinen lääkeaine. Ne vapauttavat farmakologisesti vaikuttavan lääkeaineensa elimistössä entsymaattisen tai kemiallisen reaktion seurauksena (Rautio ym. 2018). Aihiolääke voidaan muodostaa liittämällä alkuperäiseen lääkeaineeseen jonkin toinen pieni molekyyli, kuten sokeri tai aminohappo. Lääkeainetta voidaan muokata myös niin, että jonkin kemiallinen ryhmä muuntuu toiseksi esimerkiksi hapettomissa oloissa tai pH:n muutoksen seurauksena.
Aihiolääke (englanniksi prodrug) on terminä esitetty ensimmäisen kerran jo 1950-luvulla, jolloin siitä puhui Adrien Albert. Kohdennetun lääkehoidon juuret kantavat kuitenkin niinkin kauas kuin 1900-luvun alkuun, jolloin Paul Ehrlich esitti magic bullet -teoriansa lääkeaineesta, joka vaikuttaisi vain halutussa paikassaan. Kyseessä oli salvarsaani, mikrobilääke, jonka kehityksestä hänelle myönnettiin lääketieteen Nobelin palkinto vuonna 1908.
Salvarsaani oli arseenia sisältävä lääkeaine, jonka tarkoitus oli tappaa taudinaiheuttaja olematta myrkyllinen isäntäelimistölle. Keksintö olikin sittemmin pohjana nykyaikaisemman kemoterapian kehittymisessä yhtenä syövän hoitomuotona. Vaikka salvarsaanin kaltaiset lääkkeet ovat sittemmin poistettu markkinoilta, sen ajatus on yhä käytössä osana nykyaikaista lääkekehitystä, samoin kuin on aihiolääketeknologiankin. Kaikista uusista markkinoille päätyvistä lääkeaineista noin 15 prosenttia onkin nykyään aihiolääkkeitä.
Voiko kuljetinproteiinien hyödyntäminen auttaa lääkehoitojen kohdennuksessa?
Yksi tapa parantaa lääkeaineiden ”perillesaantia” on hyödyntää solukalvoilla esiintyviä proteiineja, jotka huolehtivat solujen ravinteiden ja tuotteiden sisään- ja uloskuljetuksesta. Solujen tuottamien yhdisteiden sekä ulkopuolelta saatavien ravinteiden ohella kuljetinproteiinit voivat kuljettaa myös lääkeaineita (Lee ym. 2017). Ne siis oleellisesti vaikuttavat siihen, kuinka tehokkaasti lääkeaineet pääsevät kohdekudokseen tai -soluun mutta toisaalta myös siihen, kuinka nopeasti lääkkeet poistuvat kohteesta.
Kuljetinproteiineja tiedetään jo yli 500. Kaikkia näistä ei kuitenkaan vielä tunneta, ja onkin esitetty arvioita, että jopa 10 prosenttia ihmisen geeniperimästä koodaisi yhdisteiden kulkeutumiseen osallistuvia proteiineja. Euroopan ja Yhdysvaltojen lääkeviranomaiset vaativat tällä hetkellä vain 10 hyvin tunnetun, keskeisen kuljetinproteiinin roolin tutkimista lääkeaineiden kulkeutumisessa niiden välisten yhteisvaikutusten selvittämiseksi. Tämä vastaa alle 2 prosenttia kaikista elimistömme kuljetinproteiineista.
Koska erilaisilla soluilla on eri tehtäviä, myös niiden pinnalla olevien kalvoproteiinien esiintyminen vaihtelee solutyypeittäin. Lisäksi useat sairaudet, kuten syöpä, muuttavat solujen toimintaa ja siten solujen pinnalla olevien kalvoproteiinien ilmentymistä lyhyelläkin aikavälillä. Solujen väliset erot kalvoproteiinien ilmentymisessä avaavatkin lupaavia mahdollisuuksia lääkkeiden kohdentamisen näkökulmasta.
Kalvoproteiini, jota yli-ilmentyy kohdesolussa sairauden takia tai valikoivasti terveessäkin kohdesolutyypissä, voi mahdollistaa lääkkeiden kohdennuksen. Tällöin lääkeaine suunnitellaan hakeutumaan solun pinnalla olevaan kuljetinproteiiniin, jolloin lääkeaine kulkeutuu kohteena olevaan soluun. Samalla se taas kulkeutuu vähemmässä määrin sellaisiin soluihin tai kudoksiin, joissa proteiinia ei ilmene.
Kalvoproteiineja hyödyntämällä lääkkeet eivät siis jakaudu satunnaisesti elimistössä, vaan entistä suurempi osa lääkkeistä pääsee perille haluttuun vaikutuspaikkaansa. Tämän ansiosta lääkehoidon tehoa saadaan parannettua. Toisaalta muiden solujen pienemmän altistumisen ansiosta myös haittavaikutukset pienenevät suhteessa lääkeaineiden satunnaiseen kulkeutumiseen.
Kalvoproteiinivälitteistä lääkeaineiden kohdennusta ja sopivia kuljetinproteiineja on tutkittu jo monien vaikeasti hoidettavien sairauksien osalta. Esimerkiksi aivoissa oireilevien sairauksien hoito on haastavaa aivoja suojaavan veri-aivoesteen vuoksi (Wu ym. 2023). Se rajoittaa kaikkien yhdisteiden kulkeutumista verenkierrosta aivoihin ja vastaavasti poistaa aivoille tarpeettomia yhdisteitä verenkiertoon. Usein kohdentamattomat lääkeaineet eivät ylitä veri-aivoestettä tehokkaasti, jolloin aivoihin tarkoitetun lääkkeen teho voi jäädä riittämättömäksi. Samalla lääke saattaa aiheuttaa muissa kudoksissa haittavaikutuksia.
Veri-aivoesteellä on kuitenkin paljon kuljetinproteiineja, jotka huolehtivat muun muassa aivojen ravintoaineiden kuljetuksesta. Niiden potentiaalia onkin tutkittu myös lääkeaineiden kuljetuksessa. Yksi esimerkki tällaisesta lääkkeestä on Parkinsonin taudin hoitoon käytettävä levodopa, vaikkakaan sitä ei suunniteltu alun perin kuljetinproteiini mielessä.
Myöhemmin on kumminkin havaittu, että levodopa hyödyntää kulkeutumisessaan L-tyypin aminohappokuljetinproteiini 1:sta (LAT1), ja vapauttaa kudoksissa dopamiinia entsymaattisen reaktion seurauksena. Se toimii siis kohdennettuna aihiolääkkeenä (Kageyama ym. 2000). Toisaalta levodopa kulkeutuu aivojen ohella myös muihin kudoksiin. Siksi dopamiinin vapautumista aihiolääkemuodostaan pyritään estämään sellaisilla entsyymi-inhibiittoreilla, jotka eivät pääse aivoihin. Näin vapautumista estävä liitännäislääkitys kohdentuu vain muualle elimistöön.
Toinen runsaasti tutkittu esimerkki kuljetinproteiinien hyödyntämisestä lääkeaineiden kohdentamiseksi vaikutuspaikkaansa on syövän hoito. Syöpäsolut poikkeavat elimistön terveistä soluista huomattavasti, myös niiden pinnalla esiintyvien kalvoproteiinien osalta. Niiden solukalvoilla on esimerkiksi tavanomaista enemmän ravintoaineita kuljettavia proteiineja, jotka ruokkivat syöpäsolujen voimakasta kasvua ja jakautumista.
Useiden syöpälääkkeiden vaikutustapa on estää solujen jakautumista ja täten tappaa syöpäsolut. Tämä aiheuttaa usein syöpälääkkeille ominaisia voimakkaita haittavaikutuksia myös terveissä soluissa, sillä lääkeaineita päätyy huomattavissa määrin myös terveisiin soluihin. Sen vuoksi kuljetinproteiinivälitteistä syöpälääkkeiden kohdentamista onkin tutkittu lääkehoitojen tehostamiseksi sekä niistä koettujen haittojen minimoimiseksi.
Vastaavalla tavalla poikkeavaa kuljetinproteiinien ilmentymistä hyödynnetään nykyisin jo varjoainekuvauksissa. Varjoaineilla, jotka kulkeutuvat yli-ilmentyvien kuljetinproteiinien kautta, voidaan osoittaa tarkasti syöpäsolujen sijainti. Tällaisia ovat vaikkapa edellä mainittu LAT1 tai sokereita kuljettava glukoosin kuljetinproteiini 1 (GLUT1). Esimerkiksi eturauhassyövän kuvantamisessa käytetään synteettistä aminohappoa flusikloviiniä (18F), joka hyödyntää kulkeutumiseensa korostuneita aminohappokuljettimia, kuten LAT1:tä.
Kehitystyö aluillaan mutta hyvässä vauhdissa
Toistaiseksi tutkimustulokset ovat osoittaneet, että kohdentamalla lääkeaine solukalvolla esiintyvään kuljetinproteiiniin niiden kulkeutumista soluihin voidaan kasvattaa jopa satoja kertoja tehokkaammaksi. Täten tehon puolesta lupaavien mutta vaikeasti perille saatavien lääkeaineiden kohdalla on vielä toivoa. Toisaalta kohdentaminen haluttuun proteiiniin ei ole yksinkertaista, vaan se vaatii pitkäjänteistä tutkimusta.
Kaikkia lääkeaineita ei välttämättä voida liittää sopivaan kantajayhdisteeseen. Lisäksi vaikka lääkeaine saadaan hakeutumaan kuljetinproteiiniin, täytyy sen myös kulkeutua solukalvon yli, jotta lääke pääsee vaikutuspaikkaansa. Esimerkiksi liian suuri tai muutoin epäsopiva yhdiste ei välttämättä pääse kuljetinproteiinin kanavan läpi. Tämän vuoksi proteiinin rakenne tulee tuntea hyvin, jotta tiedetään sopiva sapluuna mahdollisille lääkeaineille. Tässä voidaan hyödyntää modernia tietokoneavusteista lääkeainesuunnittelua, jotta optimaalisesti kuljetinproteiineihin sitoutuvia lääkekandidaatteja onnistuttaisiin valitsemaan jatkotutkimuksia varten.
Vaikka lääkeaine hyödyntäisikin haluttua kuljetinproteiinia, sataprosenttista kohdentamista on lähes mahdotonta saavuttaa. Kuljetinproteiineja on kaikilla solukalvoilla, joten halutulle lääkehoidon kohteelle tyypillistä kuljetinproteiinia voi olla pienempinä määrinä myös muissa soluissa. Vaikka lääkeaineen kulkeutuminen haluttuun kohteeseensa tällöin kasvaa, lääkettä päätyy myös sivukohteisiin. Tämän vuoksi kalvoproteiinien ilmentyminen kannattaa tutkia huolella.
Esimerkiksi edellä mainitun LAT1:n, jota on tutkittu aivoihin kohdennettujen lääkkeiden kohdalla, on havaittu ilmentyvän myös muissa kudoksissa, erityisen voimakkaasti haimassa (Tampio ym. 2024). Tämä johtaa siihen, että lääkeaineet kulkevat entistä tehokkaammin aivojen lisäksi myös haimaan, mikä tulee huomioida lääkekehityksen aikana. Toisaalta lääkeaineiden kasvanut kulkeutuminen sekä aivoihin että haimaan avaa uusia mahdollisuuksia toisiinsa liitettyjen sairauksien hoidossa. Sen kautta voidaan kenties puuttua samanaikaisesti sekä aivoissa oireileviin hermostorappeumasairauksiin että haiman toiminnan kautta diabetekseen liittyvään matala-asteiseen tulehdukseen ja sokeritasapainon häiriöihin.
Haasteita voi aiheuttaa myös kuljetinproteiinin valikoivuus, jolla tarkoitetaan sitä, minkälaisten yhdisteiden kanssa se voi vuorovaikuttaa. Lääkeaineet hyödyntävät usein ravintoaineiden tapaan useita eri kuljetinproteiineja. Vaikka kuljetinproteiini ilmentyy pääasiassa vain halutussa kohteessa ja lääkeaine kulkeutuu ensisijaisesti sen kautta, muissa soluissa toiset kuljetinproteiinit voivat paikata puutteen ja lääkeaine kulkeutuu silti myös muihin soluihin. Tämän vuoksi kohdennettujen lääkeaineiden kulkeutuminen tulee tuntea kohteen ulkopuolellakin. Sen lisäksi lääkeaineen tehostunut ”perillesaanti” saattaa joskus paljastaa jonkin toisen lääkeaineen puutteellisen ominaisuuden, kuten voimakkaan metabolian kohteessaan.
Lisähaasteen tutkimukseen tuo se tosiasia, että jokainen ihminen on erilainen. Yksilöiden välisten kuljetinproteiinien esiintyvyyden eroavaisuuden vuoksi yksi kuljetinproteiini voi sopia lääkehoidon kohdennuksessa yhdelle muttei välttämättä toiselle. Nämä erot voivat johtua lukuisista syistä, kuten geeniperimästä, etnisyydestä, sukupuolesta, iästä tai sairauksien aiheuttamista muutoksista, jopa ympäristön tai toisen lääkeaineen vaikutuksesta (Nishimura ym. 2008). Kun yksilöiden väliset eroavaisuudet kuljetinproteiineissa tunnistetaan ja potilaan kokonaiskuva ymmärretään paremmin, kohdennettujakin lääkehoitoja on mahdollista personoida tehokkaammin.
Kattavan tutkimuksen ansiosta tunnemme elimistöissämme esiintyviä kuljetinproteiineja päivä päivältä paremmin. Tämä auttaa tunnistamaan kuljetinproteiinit, jotka ovat keskeisiä jo käytössä oleville lääkeaineille, minkä avulla lääkkeiden yhteisvaikutuksia tai potilaskohtaisia haittavaikutuksia voidaan välttää entistä enemmän. Kasvava tieto mahdollistaa myös nykyistä paremmin kohdennettujen uusien lääkkeiden kehittämisen ottaen huomioon, että mahdollisia lääkeaineen kuljetukseen osallistuvia proteiineja on paljon. Jos potilaskohtainen kuljetinproteiinien ilmeneminen saataisiin entistä paremmin tietoon, sitä voitaisiin jatkossa hyödyntää lääkehoidon suunnittelussa.
Vaikka lääkeaineiden kuljettamiseen osallistuvien proteiinien tutkimustyö onkin vielä kesken, olemme jo monta askelta lähempänä tehokkaampia ja turvallisempia lääkehoitoja kuin 10–20 vuotta sitten. Nykyinen tutkimustieto auttaa lääkeaineiden kohdentamisessa ja luo pohjaa tulevaisuuden kohdennetuille lääkehoidoille.
•
Lue myös:
Huippututkija Kai Simons kirjoittaa omaelämäkerrassaan yhteistyön voimasta
Kirurgisia leikkauksia, joita ei tulisi tehdä
Voidaanko päihderiippuvuuksiin ja lihavuuteen kehittää lääkehoitoja?
•
Haluatko pysyä kärryillä uusimmista tiedeartikkeleista? Tilaa Tieteessä tapahtuu -uutiskirje!
Kirjallisuus
Artikkeleita ja Tiedemaailma-artikkeleita



